المادة
المادة هي كلّ جسم له كتلة وحجم ويشغل حيزاً في الفراغ، وهي المادة من مجموعة أجزاء صغيرة تسمى جزيئات تتركب من أجزاء أصغر منها وتسمى ذرات، وتوجد المادة في الطبيعة على ثلاثة أشكال رئيسية هي العناصر والتي لا يمكن تحويلها إلى مواد أبسط منها، والمركبات التي تنتج من اتحاد عنصرين أو أكثر، والمخلوط الناتج من اتحاد مادتين معاً دون أي اتحاد كيميائي.
العناصر والجزئیات
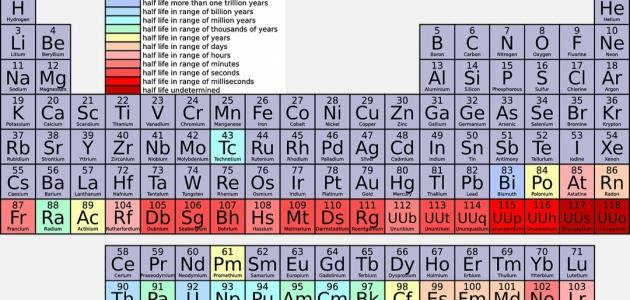
العناصر الكيميائية
العناصر الكيميائية موجودة في الطبيعة، فالعنصر الكيميائي عبارة عن مادّة كيميائية تحتوي على نوع فقط من الذرات، وتتميّز بأنّ لها عدداً ذرياً خاصاً بها، ولا يُمكن لها التحلل كيميائياً إلى موادّ أبسط منها، وتكون هذه العناصر على سطح الأرض أو في باطنها، ومن الأمثلة عليها: الهيدروجين، والهيليوم، والكربون، والأكسجين، والنتروجين، ويبلغ عدد العناصر الكيميائيّة 116 عنصراً مرتبة في الجدول الدوري، ويعتبر الأكسجين من أكثر العناصر وفرة في القشرة الأرضيّة.
تقسم العناصر الكيميائية إلى عناصر كيميائية فلزية وهي العناصر التي تميل إلى خسارة الإلكترونات لتكوين أيونات موجبة مثل النحاس والحديد والنيكل والتيتانيوم، وتتميز بلمعانها وبريقها المميز، وقابليتها للطرق والسحب والتشكيل، والعناصر الكيميائية اللافلزية وهي العناصر الكيميائية التي تميل إلى كسب إلكترونات التكافؤ من الذرات الأخرى، ومن أهم العناصر اللافلزية الهيدروجين، والنيتروجين، والأكسجين، والفلور، والكلور، وتتميز بأنّها عازلة أو شبه موصلة للتيار الكهربائي، وهي غير قابلة للطرق والسحب والتشكيل.
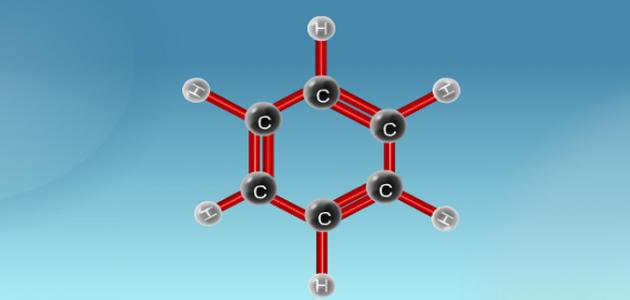
الجزيئات
الجزيء هو عبارة عن مجموعة من الذرات اثنتين أو أكثر تُربط معاً باستخدام روابط كيميائية، وهو أصغر وحدة من المادة الكيميائية النقية، ويحفظ تركيبها وخصائصها الكيميائية، ويلعب كذلك بناء الجزيء دوراً مهماً في تحديد القطبية، وحالة المادة، واللون، والمغناطيسية وخصائص أخرى عديدة,
إنَّ معظم الجزيئات الكيميائية صغيرة الحجم ولا يمكن رؤيتها بالعين المجردة، أمّا الروابط التي تربط بين الذرات في الجزي فتكون روابط أيونية أو روابط تساهمية، بالإضافة إلى قوى ترابط أخرى تجمع الجزيئات مع بعضها وهي قوى التجاذب بين الجزيئات ثنائية القطب حيث تتجاذب الأطراف ذات الشحنات المختلفة للجزيئات القطبية وتصبح أكثر ثباتاً، وتزداد قوة التجاذب بازدياد القطبية، و قوى التجاذب بين الجزيئات غير القطبية حيث تنتج هذه القوى من الفعل المتبادل بين الإلكترونات في الجزيئات، فتحدث إزاحة لحظية تؤدي إلى قطبية مؤقتة وتجاذب ضعيف، بالإضافة إلى الرابطة الهيدروجينية التي تتكون بين جزيئات قطبية فيها ذرات الهيدروجين مرتبطة تساهمياً مع ذرات صغيرة الحجم ذات كهروسالبية عالية.