'); }
أساس جدول مندلييف
(بالإنجليزية: Mendeleev’s Table)، وهو الجدول المعروف بالجدول الدوري، والذي قام بوضعه الكيميائي والمدرس الروسي ديمتري مندلييف (Dmitri Mendeleev)،[١] وذلك عندما بدأ بتدريس الكيمياء العضوية، ولكنه لم يجد الكتاب الدراسي الذي يستوفي احتياجاته التدريسية، فنشر كتاباً عن الكيمياء العضوية في عام 1861، ومن ثم بدأ بكتابة كتاب آخر، وهو كتاب مبادئ الكيمياء في عام 1868، وعندما بدأ بكتابة الفصل الخاص بعناصر الهالوجين وهو الكلور ونظائره، قام بمقارنة خصائص هذه المجموعة من العناصر مع مجموعة المعادن القلوية، مثل: الصوديوم، وقد اكتشف في هاتين المجموعتين من العناصر غير المتشابهة، أوجه التشابه في تطور الأوزان الذرية، وقد تساءل فيما إذا كان يوجد مجموعات أخرى من العناصر تُظهر نفس الخصائص.[٢]
وبعد دراسة الأتربة القلوية، قام مندلييف بإثبات أنه يمكن استخدام ترتيب الأوزان الذرية لترتيب العناصر داخل كل مجموعة، وترتيب المجموعات نفسها أيضاً، وثم عمل على فهم الخصائص الكيميائية والفيزيائية للعناصر الكيميائية ومركباتها، مما جعله يكتشف القانون الدوري، الذي أعلن عنه أمام الجمعية الكيميائية الروسية في شهر آذار كم عام 1869، وهو عبارة عن عناصر مرتبة حسب قيمة أوزانها الذرية، وقد ساعده هذا القانون في إعداد جدول منهجي لجميع العناصر التي كانت معروفة في وقته.[٢]
'); }
تاريخ جدول مندلييف
بدأ العلماء قبل عام 1869 بتصنيف وترتيب العناصر الكيميائية التي كانت معروفة في ذلك الوقت، والتي تبلغ 63 عنصراً، ومنها: الذهب، والفضة، والقصدير، والزئبق، والنحاس، والرصاص، وقد تم اكتشاف العديد من العناصر على مدى الـ 220 سنة، وخلال هذا الوقت قام العلماء بتحديد العناصر الفردية، وتعلموا العديد من الخصائص الكيميائية الأخرى، من خلال تعريض العناصر الفردية لمواد كيميائية مختلفة بطريقة منهجية، وعن طريق مراقبة التفاعلات، مما جعلهم بحاجة إلى طريقة لتنظيم العناصر بطريقة مفيدة، وقام العديد من العلماء ومن ضمنهن مندلييف في العديد من المساهمات لإيجاد الجدول الدوري المعروف.[٣]
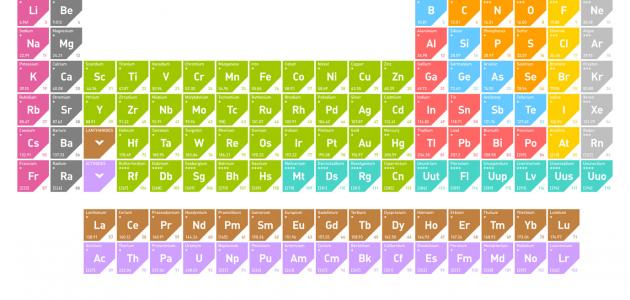
ترتيب الجدول الدوري
تُرتب جميع العناصر الكيميائية المعروفة في الجدول الدوري حسب مصفوفة علمية، بحيث يتم ترتيبها من اليسار إلى اليمين، ومن الأعلى إلى الأسفل حسب زيادة العدد الذري، كما أنه يتطابق مع زيادة الكتلة الذرية، وتسمى الصفوف في الجدول الدوري بالدورات، ويشير رقم الدورة للعنصر إلى أعلى مستوى من يشغله الإلكترون في هذا العنصر، أما العناصر المرتبة في نفس العمود فتسمى مجموعة، والتي لها تكوينات إلكترون متوازنة ومتماثلة، مما يجعلها تتصرق بطريقة مشابهة كيميائياً.[٤]
المراجع
- ↑ “Dmitri Mendeleev”, www.khanacademy.org, Retrieved 20-4-2018. Edited.
- ^ أ ب Bernadette Bensaude-Vincent, “Dmitri Mendeleev”، www.britannica.com, Retrieved 20-4-2018. Edited.
- ↑ “Compare-Contrast-Connect: The History of Mendeleev’s Table”, www.manoa.hawaii.edu, Retrieved 20-4-2018. Edited.
- ↑ Tim Sharp (28-8-2017), “Periodic Table of Elements”، www.livescience.com, Retrieved 20-4-2018. Edited.