محتويات
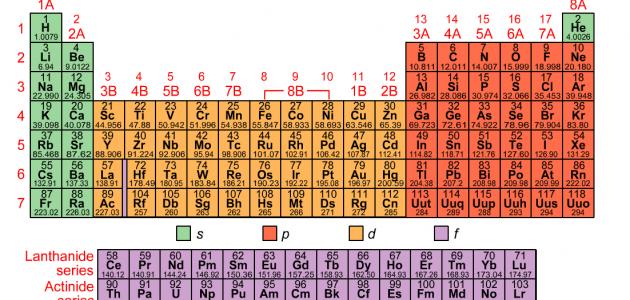
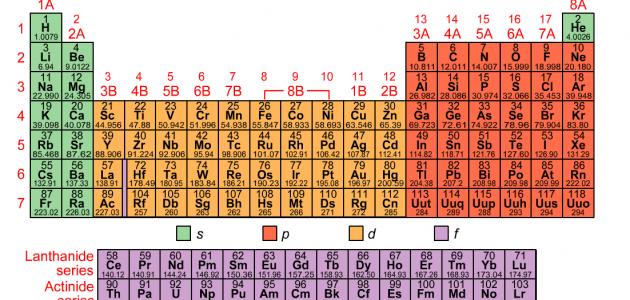
يحتوي الجدول الدوري حالياً على 118 عنصراً، وبعض هذه العناصر موجود في الطبيعة، بينما يتم إنشاء بعضها الآخر في المختبر،[١] ومؤخراً في شهر كانون الأول من عام 2015م قام الاتحاد الدولي للكيمياء البحتة والتطبيقية بتثبيت أربعة عناصر لإكمال الصف أو الدورة السابعة من الجدول الدوري، وهذه العناصر هي:[٢]
- العنصر 113: اسمه المؤقت هو أنون تريوم، واسمه الرسمي هو نيهونيوم، ورمزه هو Nh.
- العنصر 115: اسمه المؤقت هو أنون بينتيوم، واسمه الرسمي هو موسكوفيوم، ورمزه هو Mc.
- العنصر 117: اسمه المؤقت هو أنون سيبتيوم ، واسمه الرسمي هو تينيسين، ورمزه هو Ts.
- العنصر 118: اسمه المؤقت هو أنون أوكتيوم، واسمه الرسمي هو أوغانيسون، ورمزه Og.
يحتوي الجدول الدوري على المعلومات الآتية:[٢]
- العدد الذري: هو عدد البروتونات في الذرة، ويمكن من خلاله معرفة العنصر، وتحديد السلوك الكيميائي له؛ فمثلاً تمتلك ذرات الكربون ست بروتونات، وذرات الهيدروجين بروتوناً واحداً، وذرات الأكسجين ثمانية بروتونات.[٢]
- الرمز الذري أو رمز العنصر: هو اختصار تم اختياره لتمثيل العنصر؛ فمثلاً رمز عنصر الكربون هو C، ورمز عنصر الهيدروجين هو H، ورمز عنصر الأكسجين هو O، وتستخدم هذه الرموز دولياً، وقد تكون أحياناً غير متوقعة؛ فمثلاً يُرمز للتنغسن بالرمز W لأنّ له اسماً آخر هو Wolfram. [٢]
- الوزن الذري أو الكتلة الذرية: هو مجموع كتلة البروتونات والنيوترونات في الذرة؛ حيث تساهم الإلكترونات في كتلة الذرة بشئ لا يُذكر، وقد تختلف قيم الوزن الذري من جدول دوري إلى آخر؛ لأنّه رقم محسوب، ويتم حسابه اعتماداً على متوسط أوزان النظائر الطبيعية لعنصر ما.[٣]
يُطلق على الأعمدة الرأسية في الجدول الدوري اسم المجموعات أو العائلات، وتمتلك عناصر المجموعة ذاتها في الجدول الدوري خصائص مماثلة، وترقَّم المجموعات في الجدول الدوري من 1-18 من اليسار إلى اليمين، وتمتلك بعض المجموعات أسماء خاصة بها؛ فمثلاً يُطلق على عناصر المجموعة الأولى من الجدول الدوري باستثناء الهيدروجين اسم المعادن القلوية، وهي عناصر ناعمة وفضية اللون، وتتفاعل بعنف مع الماء لتشكيل محلول قلوي أو قاعدي،[١] كما يُطلق على صفوف الجدول الدوري اسم الدورات، ويشير رقم المجموعة إلى أعلى مستوى طاقة يحتله الإلكترون في ذرة العنصر، في حالة عدم الإثارة.[٢]
- ^ أ ب Kristin Born، “The Periodic Table: Properties of Groups and Periods”، www.study.com، Retrieved 21-12-2017. Edited.
- ^ أ ب ت ث ج Tim Sharp (28-8-2017)، “Periodic Table of Elements”، www.livescience.com، Retrieved 21-12-2017. Edited.
- ↑ Anne Marie Helmenstine، Ph.D. (12-9-2017)، “Clickable Periodic Table of the Elements”، www.thoughtco.com، Retrieved 21-12-2017. Edited.