محتويات
'); }
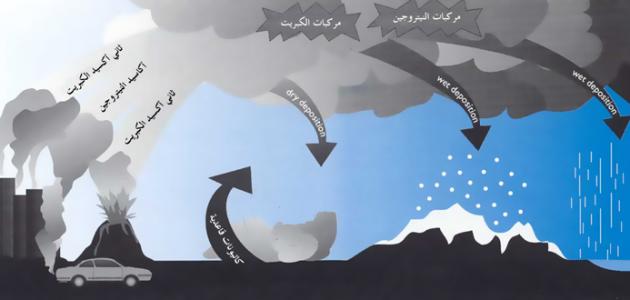
كيفية تكون المطر الحمضي
يُعتبر المطر الحمضيّ من أخطر المشكلات البيئية التي يواجهها العالم في الوقت الحالي، إذ إنّه يتكوّن نتيجة تفاعل المطر مع المركّبات الكيميائية الضارة الموجودة في الغلاف الجويّ، مثل: مركّبات ثاني أكسيد الكبريت وأكاسيد النتروجين، حيث تتمتّع هذه الأكاسيد بقابلة عالية للذوبان في الماء، كما أنّها تتفاعل أيضاً مع الأكسجين والمواد الكيميائية الأخرى الموجودة في الغلاف الجويّ فتُكوّن ملّوثات حمضية يَسهُل نقلها وحملها بواسطة الرياح فتُصبح هذه الملوّثات جزءاً من المطر والثلوج والضباب، وتكمن خطورة المطر الحمضي بدرجة حموضته المرتفعة فوق المعدّل الطبيعي، وعند هطوله على مناطق تضم بحيرات وأنهار فإنهّ يُغيّر من التركيب الكيميائي لها ويؤثّر سلباً على النظام البيئيّ والكائنات الحية التي تعيش فيه، وتُعدّ كندا والولايات المتّحدة من أكثر الدول تضرّراً بهذه الظاهرة.[١][٢]
تُقاس درجة حموضة الأمطار الحمضية عن طريق مقياس درجة الحموضة الذي يُرمز لها بالرمز (pH) ويسمّى أيضاً بالرقم الهيدروجيني، وهو مقياس يصنّف المواد حسب درجة حموضتها إلى مواد حامضيّة أو متعادلة أو قاعدية من 0 إلى 14، حيث يُشير الرقم 0 إلى المواد الأكثر حامضية والرقم 14 إلى المواد الأكثر القاعدية، والمواد التي تحمل الرقم الهيدروجيني 7 هي المواد المتعادلة أيّ أنّها لا تكون حمضيةً ولا قاعدية، وتتراوح درجة حموضة المطر الطبيعي غير الملّوث وقبل امتزاجه بالأكاسيد بين 5 و 6، وعند تلّوثه بأكاسيد النتروجين وثاني أكسيد الكبريت تزداد درجة حموضته لتصل إلى 4، وقد تمّ تسجيل بعض الأمطار الحمضية بدرجة حمضية وصلت إلى 2.[٣]
'); }
معادلات تكوّن المطر الحمضي
يتكوّن المطر الحمضي نتيجة عمليات متتالية من التفاعلات الكيميائية بين المركّبات الحمضية ومياه الأمطار، يُمكن تقسيم هذه المعادلات كالآتي:[٤]
معادلات تفاعل مياه الأمطار مع أكاسيد النتريك
تتكوّن أكاسيد النتريك نتيجة احتراق الوقود في درجات حرارة مرتفعة داخل محرّكات الاحتراق الداخلي، وبسبب عمليّات التفريغ الكهربائي للبرق في الجو، حيث تتفاعل جزئيات النتروجين والأكسجين لتكوين أكسيد النتريك، وفقاً للمعادلة الآتية:
N2(g) + O2(g) → 2NO (g)
ويتفاعل أكسيد النتريك الناتج من المعادلة السابقة مع كمية من الأكسجين الزائد ليتكوّن ثاني أكسيد النتروجين، وهو المركّب المسؤول عن اللون البنّي الضبابي في الغلاف الجوّي، ومعادلة تكوّنه كالآتي:
2NO (g) + O2(g) → 2NO2(g)
ثمّ يذوب ثاني أكسيد النتروجين في الماء فيُشكّل مركباً كيميائياً جديداً من حمض النتروز وحمض النتريك بنسبة 1:1، ويحدث ذلك وفقاً للمعادلة الآتية:
2NO2(g) + H2O (l) → HNO2(aq) + HNO3(aq)
وفي النهاية فإنّ جزئيات الأكسجين تُأكسد حمض النتروز إلى حمض النتريك، وهذا يعني أنّ التفاعل النهائي لتكوّن حمض النتريك يكون كالآتي:
2N2(g) +5O2(g) +2H2O (l)→4HNO3(aq)
معادلات تفاعل مياه الأمطار مع ثاني أكسيد الكبريت
يذوب ثاني أكسيد الكبريت في مياه الأمطار ليتكوّن حمض الكبريتوز (H2SO3) وفق المعادلة الآتية:
SO2(g) + H2O (l) → H2SO3(aq)
ثمّ يتأكسد حمض الكبريتوز بواسطة الأكسجين ليتكوّن حمض الكبريتيك (H2SO4) وفق المعادلة الآتية:
2H2SO3(aq) + O2(g) → 2H2SO4(aq)
أسباب تكوّن المطر الحمضي
تُعتبر المصادر الطبيعية مثل الانبعاثات البركانية والعمليات الحيوية المختلفة التي تحدث على اليابسة والأسطح المائية بأنواعها مصدراً للغازات الحمضية في الغلاف الجويّ، حيث وُجدت آثارٌ لرواسب حمضية في المناطق النائية الجليدية في العالم يعود أصلها إلى آلاف السنين في الماضي، أمّا الأنشطة البشرية المؤديّة لانبعاث الغازات الحمضية للغلاف الجوي وتلوّث الهواء فتتمثّل في احتراق الفحم، واستخدام النفط والغاز الطبيعي في محطات توليد الطاقة الكهربائية، وعمليات احتراق الوقود لغايات الطهي أو تشغيل محرّكات وسائل النقل المختلفة، ممّا يؤدّي إلى إطلاق أكسيد الكبريت وأكاسيد الكربون وأكاسيد النتروجين وغيرها من الغازات الضارة للبيئة، ومن الجدير بالذكر أنّ ثلثي كمية ثاني أكسيد الكبريت وربع كمية أكسيد النتروجين الموجودة في الغلاف الجوّي مصدرها من محطات توليد الطاقة الكهربائية.[٥][٦]
المراجع
- ↑ Jenn Savedge, “The Harmful Effects of Acid Rain”، www.thoughtco.com, Retrieved 5-8-2020. Edited.
- ↑ “What Causes Acid Rain?”, www3.epa.gov, Retrieved 5-8-2020. Edited.
- ↑ “Acid Rain”, projects.ncsu.edu, Retrieved 2020-8-27. Edited.
- ↑ “Acid rain”, www.omicsonline.org, Retrieved 5-8-2020. Edited.
- ↑ J Earth Sci Clim, “Mechanisms and Effects of Acid Rain on Environment”، www.omicsonline.org, Retrieved 5-8-2020. Edited.
- ↑ Alina Bradford (14-7-2018), “Acid rain”، www.livescience.com, Retrieved 5-8-2020. Edited.