الذّرّة
تُعرّف الذّرّة على أنّها أصغر ما يمكن الوصول إليه في العنصر الكيميائيّ مع الاحتفاظ بالخصائص الكيميائيّة للعنصر، واعتُقِد قديماً أن الذّرّة غير قابلةٍ للانقسام وأنّها أصغر شيء في الوجود، ومن هنا أُطلِق عليها اسم أتوموس في اللغة الإغريقية ويقابلها (atom) في اللغة الإنجليزيّة.
مع تطوّر العلم توصّل العلماء إلى أنّ الذّرّة تحتوي على عددٍ من الشّحنات السّالبة وتُعرف بالإلكترونات، وتدور حول النّواة التي تحمل شحنةً موجبةً؛ وذلك نظراً لاحتوائها على عددٍ من البروتونات الموجبة، وعدد من النّيوترونات مُتعادلة الشّحنة، وبهذا تكون لكلّ الذرّات في الكون ثلاثة مكوّنات هي: الإلكترونات، والبروتونات، والنّيوترونات، وهذه المكوّنات موجودةٌ في العناصر كلّها بلا استثناء، ولكنّ ما يختلف فيها هو عددها.
النّيوترون
كان الاعتقاد سائداً في القِدم بأنّ النّيوترون جسيم أوليّ (أي إنّه غير قابلٍ للانقسام أو الانشطار)، ولكن ثبت خطأ هذا الاعتقاد فيما بعد؛ حيث عُرِف ما يُسمّى بالنّيوترون الحرّ، وهو الذي يوجد خارج نواة الذّرّة ويكون غير مستقر؛ لذا ينقسم إلى إلكترون وبروتون بعد حوالي خمس عشرة دقيقة من تواجده، والسّبب وراء تأخّر اكتشاف ماهيّة النّيوترونات هو أنّها عَديمة الشّحنة، فكان أوّل من اكتَشفها عالم الفيزياء جيمس شادويك الحاصل على جائزة نوبل.
يتميّز النّيوترون بقدرته الكبيرة على النّفاذ في المواد، وبهذا فإنّ الطّريقة الوحيدة لتغيير مسار أيّ نيوترون هي بوضع نواةٍ في طريقه؛ ليحصل تصادم تام مرن بين النّواة والنّيوترون، ولهذا تُستخدمُ النّيوترونات لشطر أنوية اليورانيوم في المفاعلات النّوويّة، بحيث يزداد الانشطار بالتّفاعل المتسلسل، وفي هذا التّفاعل توجد دائماً مواد تمتصّ النّيوترونات الزائدة عنه؛ وذلك لإبقائه متوازناً.
عدد النّيوترونات في نواة الذّرّة
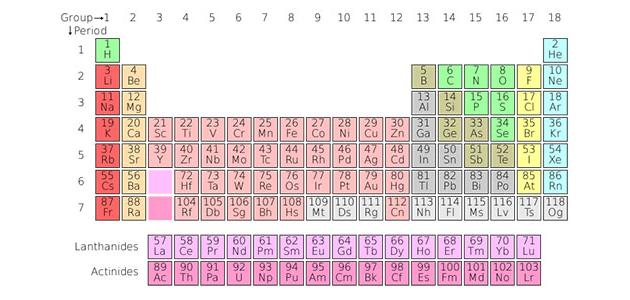
لكلّ عنصرٍ من عناصر الجدول الدّوريّ عددان معروفان هما: العدد الذّريّ، والعدد الكتليّ، فالعدد الذرّي هو نفسه عدد البروتونات في النّواة، وهو أيضاً نفسه عدد الإلكترونات، أمّا العدد الكتليّ فهو العدد النّاتج من جمع عدد النّيوترونات مع العدد الذريّ أو عدد البروتونات، ورياضياً:
- العدد الذريّ=عدد البروتونات= عدد الإلكترونات
- العدد الكتليّ=عدد البروتونات+عدد النّيوترونات
- وبما أنّ كلاً من العدد الذريّ والعدد الكتليّ للعنصر معروفان، حينئذٍ سنعرف عدد النّيوترونات، وذلك باستخدام هذه المعادلة:
- عدد النّيوترونات=العدد الكتليّ – عدد البروتونات
مثال توضيحيّ:
إذا كان عنصر الصّوديوم في الجدول الدّوريّ يحمل العددين: 11 ( العدد الذريّ)، و23 (العدد الكتليّ)، فما هو عدد النّيوترونات لذرّة الصّوديوم؟
- الحلّ:
- عدد النّيوترونات= العدد الكتلي- العدد الذريّ
- عدد النّيوترونات= 23-11
- عدد النّيوترونات=12