محتويات
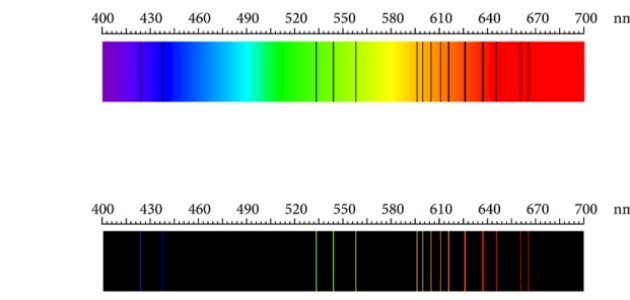
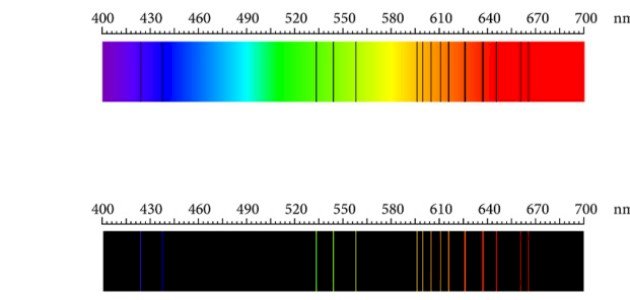
الطيف الذري هو طيف خطي غير متصل يظهر على هيئة خطوط ملونة منفصلة عن بعضها البعض عند استثارة الذرات في الحالة الغازية،[١] والطيف هو ناتج تحلل الأمواج الكهرومغناطيسية سواء كانت مرئية أو غير مرئية؛ حيثُ يتكون الضوء في الأصل من أمواج كهرومغناطسية، وينقسم إلى قسمين طيف الامتصاص الخطي وطيف الانبعاث أو الإشعاع الخطي، وفيما يأتي توضيح لهذه الأقسام:[١]
حيث يظهر على شكل خطوط منفصلة سوداء في ناتج تحليل الطيف للعنصر عند استثارة ذرات العنصر في الحالة الغازية بغياب مصدر للحرارة ويرجع ذلك لانتقال الإلكترونات من مستوى طاقة أدنى إلى مستوى طاقة أعلى.[١]
على خلاف طيف الامتصاص، يظهر طيف الانبعاث على شكل خطوط منفصلة ملونة عند استثارة العنصر في الحالة الغازية بوجود مصدر للحرارة وذلك بسبب انتقال الإلكترونات من مستوى طاقة أعلى إلى مستوى طاقة أدنى أي عندما تعود الإلكترونات لمستويات الاستقرار.[٣]
ويعتبر الطيف الذري بصمة مميزة لكل عنصر ويرجع ذلك إلى أن كل عنصر يمتلك بنية ذرية مميزة وهو ما يتيح احتمالات مختلفة لحركة الإلكترونات بين مستويات الطاقة والتي ينتج عنها طيف امتصاص أو انبعاث مميز.[٣]
تساعدنا دراسة الطيف الذري في العديد من المجالات، ومن أهمّها ما يأتي:
- استكشاف المجرات والنجوم من حولنا وذلك لأن لكل عنصر بصمته الخاصة فإن تحليل الضوء الواصل للأرض من النجوم والمجرات البعيدة يساعدنا في فهم العديد من خصائص هذه الأجرام، ومنها التركيب الكيميائي لنجم ما ودرجة حرارته وكثافته وبعده عن الأرض ودرجة الإشعاع أو السطوع.
- تحديد نقاوة المواد المحفزة في الصناعات الدوائية، وفي الصناعات التعدينية، فتستخدم لتحديد نوع وكم عناصر ثمينة مثل الذهب والفضة.
يفترض العالم بور أن الذرة عبارة عن نواة ذات كثافة عالية محاطة بالإلكترونات، والتي تدور في مدارات لها طاقة محددة تشبه إلى حدٍّ ما تكوين الأنظمة الفلكية إذ يحافظ على بناء النموذج القوة الكهروسكونية بين النواة والإلكترونات.[١]
تمّكن بعض العلماء بالاعتماد على هذا النموذج من ملاحظة وجود ما يُعرف بسلاسل طيف الانبعاث الخطي، إذ تتكون هذه السلاسل نتيجة انتقال الإلكترونات المثارة من مستوى طاقة أعلى إلى مستوى طاقة أدنى. ومن أشهر هذه السلاسل:[١]
- سلسلة ليمان
عندما يعود الإلكترون من أي مستوى طاقة إلى الأول فإن الانبعاث الناتج في هذه الحالة يقع ضمن طاقة الأشعة فوق البنفسجية.
- سلسلة بالمر
عندما يعود الإلكترون المثار من مستوى الطاقة الخارجي إلى مستوى الطاقة الثاني فإن الانبعاث الناتج ينتمي إلى نطاق الأشعة المرئية.
- سلسلة باشن
عندما يعود الإلكترون المثار من مستوى الطاقة الخارجي إلى المستوى الثالث فإن الانبعاث الناتج يقع ضمن منطقة الأشعة تحت الحمراء.
- ^ أ ب ت ث ج “Spectroscopy in Astronomy”, courses. Edited.
- ^ أ ب علاء علي (10/1/2022)، “لماذا يختلف الطيف الذري من عنصر إلى اخر”، المرسال، اطّلع عليه بتاريخ 15/1/2022. بتصرّف.