محتويات
تُعرّف المركبات الكيميائيّة على أنّها مواد تكونت من اتحاد عنصرين أو أكثر بنسبة ثابتة برابطة كيميائية مثل الروابط الأيونية، والتساهمية، فعلى سبيل المثال يُعتبر ملح الطعام مركباً كيميائياً، وذلك لأنّه يتكون من اتحاد عنصريّ الصوديوم والكلور بنسبة ثابتة وهي 1:1، وتتميز المركبات الكيميائية بأنّها يمكن أنّ تتحلل لمكوناتها الأصلية عن طريق تفاعل كيميائي.[١]
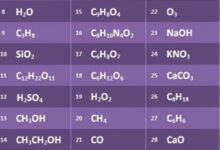
يُوجد ما يُقارب 10 ملايين مركباً كيميائياً معروفاً، وتُصنّف جميع المُركبات الكيميائية إلى نوعين رئيسيين، هما؛ المركبات العضوية، والمركبات غير العضوية، وفيما يأتي نبذة عن كلّ من هذه المركبات:[٢]
تُشّكل المركبات العضوية أكثر من 90% من المركبات الكيميائيّة، ويُمكن تعريفها على أنّها مركبات تحتوي على عنصر الكربون، وتُصنّف المركبات العضوية إلى عشرات العائلات الرئيسيّة اعتماداً على وجود مجموعة وظيفيّة مُميزة تُحدد بقوة الخصائص الفيزيائيّة والكيميائيّة لأفرادها، ومن هذه العائلات: الألكانات، والألكينات، والألكاينات، والكحول، والألدهيدات، والكيتونات، والأحماض الكربوكسيلية، والأمينات، وغيرها، وتضمّ المركبات العضوية مجموعةً فرعيةً مهمةً؛ لأنّها تُوجد في أجسام الكائنات الحية وهي المركبات الكيموحيوية (بالإنجليزيّة: biochemical compounds)؛[٢] التي تنقسم إلى 4 مجموعات رئيسية وهي الآتية:[٣]
- الكربوهيدرات: مركبات تستخدمها الكائنات الحية لإنتاج الطاقة ومن الأمثلة عليها: الجلوكوز، والفركتوز، والسكروز، والسليولوز، وغيرها.
- الدهون: مركبات تُستخدم لتخزين الطاقة، وبناء الهياكل، وكجزيئات إشارة تُساعد الخلايا على التواصل مع بعضها، وتُقسم بدورها إلى 3 مجموعات كالآتي:
- ثلاثي الغليسريد، مثل الدهنيات، والزيوت، والشموع.
- الدهن الفسفوري.
- الستيرويدات.
- البروتينات: مواد تُستخدم لبناء الخلية، وتحفيز التفاعلات الكيميائيّة الحيويّة، والاستجابة المناعيّة، وتعبئة المواد ونقلها، والمساعدة في استنساخ المواد الجينية، ومن الأمثلة عليها الانزيمات، والكولاجين، والكيراتين، والهيموغلوبين.
- الأحماض النووية: مركبات مكونة من وحدات بنائية تسمى النيوكليوتيدات تُستخدم لتشفير المعلومات الجينية للكائن الحي، ومن الأمثلة عليها الأحماض النووية (DNA)، و(RNA).
تُعرّف المركبات غير العضوية على أنّها مركبات كيميائية تتكون من اتحاد عنصرين أو أكثر ليس من ضمنها عنصر الكربون المرتبط بالهيدروجين،[٤] ويُمكن تقسيم المركبات غير العضوية إلى المجموعات الرئيسيّة الآتية:[٢]
- الأكاسيد: مركبات أيونها السالب هو دائماً الأكسجين.
- الأحماض: مركبات تنفصل في محلول مائي وتُنتج أيونات الهيدروجين،[٢] وتتفاعل مع القواعد لتكوين الملح والماء، ومن الأمثلة عليها حمض الهيدروكلوريك (HCl)؛ الذي تُفرزه المعدة للمساعدة على الهضم، وحمض الكلوريك (HClO3).[٥]
- الأملاح: مادة تتفكك عند إذابتها في الماء إلى أيونات ليس من ضمنها (H+) أو (OH-)، ومن الأمثلة عليها ملح الطعام.[٦]
- القواعد: مركبات تتأين أو تنفصل في محلول مائي لإنتاج أيونات الهيدروكسيد، أو مركبات يمكنها استقبال أيونات الهيدروجين من محلول، ومن الأمثلة عليها البيكربونات (HCO3–).[٦]
تُشكّل المركبات الكيميائية جزءاً كبيراً من حياة الإنسان اليومية، حيث يستخدم الإنسان الكثير من المواد التي تحتوي على مركبات كيميائية دون أنّ يُدرك ذلك، ومن الأمثلة على ذلك: معجون الأسنان، والصابون، والمواد الحافظة للطعام، والأدوية، ومستحضرات التجميل، والأسمدة، والمبيدات الحشرية، والوقود، وغيرها.[٧]
- ↑ “Definition of Compound”, www.chemicool.com, Retrieved 20-4-2021. Edited.
- ^ أ ب ت ث “Compound”, www.encyclopedia.com, Retrieved 20-4-2021. Edited.
- ↑ Anne Helmenstine (25-11-2019), “Types of Organic Compounds”، www.thoughtco.com, Retrieved 20-4-2021. Edited.
- ↑ “Inorganic compound”, www.britannica.com,5-6-2020، Retrieved 20-4-2021. Edited.
- ↑ “Acid”, www.newworldencyclopedia.org, Retrieved 20-4-2021. Edited.
- ^ أ ب “Inorganic Compounds Essential to Human Functioning”, www.pressbooks-dev.oer.hawaii.edu, Retrieved 20-4-2021. Edited.
- ↑ Utsav Poudel (2020), Chemistry in Everyday Life , Lalitpur, Nepal: Tribhuvan University, Page 1-5. Edited.